细胞能量方面的研究揭示了决定细胞命运和对损伤反应的代谢通路在其中的重要作用。从 2017 年这些信号通路的潜在机制方面的研究中,可能能确定治疗的靶目标,并尽可能减少损伤,促进修复。荷兰莱顿大学医学中心肾内科和再生医学系的 Ton J Rabelink 教授在 2017 年 12 月的 Nature Review Nephrology 杂志上撰写了相关的综述。
关键进展
1. 糖酵解和线粒体呼吸能力的增加刺激了前体细胞的细胞增生和自我更新。
2. 急性肾损伤和糖尿病肾病都以线粒体功能障碍和糖酵解的中间产物的堆积为特点,这些中间产物可以代谢为有毒性的终端产物。
3. 糖酵解通量伴随线粒体呼吸功能的耦合正在成为缺血性肾脏损伤和糖尿病性肾脏损伤的潜在有希望的治疗方法。
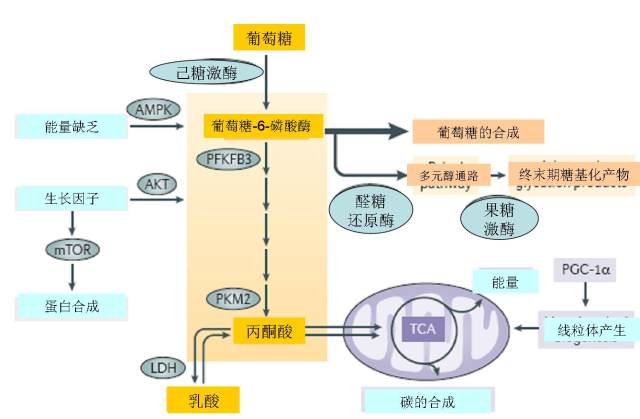
图 1 糖酵解代谢途径
注:LDH 乳酸脱氢酶;TCA 三羧酸循环;PKM2 丙酮酸激酶 M2;AMPK AMP 激活的蛋白激酶;AKT 生长因子信号;
PFKFB3 6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶 3;PGC1α 过氧化物酶体增殖物激活受体共激活因子 1;
细胞的葡萄糖通过己糖激酶穿梭进入糖酵解途径。一些糖酵解的产物用于糖的合成(例如,粘多糖的产生和糖基化过程),一些用于能量产生。糖酵解关键的活化酶,比如 6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶 3(PFKFB3),受细胞能量状态的调节(通过 AMP 激活的蛋白激酶 AMPK 信号途径或者生长因子 AKT 信号途径),这些也都与雷帕霉的机制素靶点(mTOR)调节的蛋白合成紧密相关。
糖酵解终产物丙酮酸的产生是通过丙酮酸激酶 M2(PKM2)掌控的,同样还刺激线粒体功能。三羧酸循环(TCA)使用丙酮酸(和乳酸来源的丙酮酸)、谷氨酰胺和游离脂肪酸作为能量来源,使细胞产生能量。与 PKM2 一样,过氧化物酶体增殖物激活受体共激活因子 1(PGC1α)间接刺激线粒体合成和功能,增加细胞的呼吸能力。出现线粒体功能障碍时,糖酵解的中间产物蓄积,穿梭进入多元醇通路,在此通路中代谢为果糖和其后有毒性的糖基化终末产物。
