目前,对于继发性 IgA 肾病的定义尚没有统一的意见。通常所说的继发性 IgA 肾病是指存在系统性疾病的患者同时出现 IgA 免疫复合物介导的肾脏损伤。由于继发性 IgA 肾病和原发性 IgA 肾病在组织学表现上并没有明显不同,所以诊断主要依靠临床分析。越来越多的系统性疾病同时出现 IgA 肾病表现,提示两者之间可能存在因果关系。
美国北卡罗琳娜大学 Saha 医生等人综述了目前最常见的继发性 IgA 肾病及可能的病理生理机制,发表在 2018 年近期的 Kidney International 杂志上,供大家参考学习。
表 1 继发性 IgAN 相关的系统性疾病
胃肠道和肝脏疾病 肝脏疾病(酒精性肝硬化、丙肝、非酒精性脂肪肝) 乳糜泻 克隆恩病 溃疡性结肠炎 |
病毒感染 艾滋病毒 巨细胞病毒 乙肝病毒 丙肝病毒 |
其他感染 慢性粘膜感染(链球菌,葡萄球菌) 慢性感染(葡萄球菌) 莱姆病,肺炎衣原体 疟疾、血吸虫病 |
自身免疫性疾病 强直性脊柱炎 类风湿性关节炎 系统性红斑狼疮 疱疹样皮炎 干燥综合征 银屑病 |
呼吸道疾病 慢性阻塞性细支气管炎 支气管肺炎 特发性肺纤维化 囊性肺纤维化 |
肿瘤 IgA 骨髓瘤 非霍奇金淋巴瘤 霍奇金淋巴瘤 皮肤 T 细胞淋巴瘤 肺癌 肾细胞癌 |
为了更好地理解 IgAN 的病理生理机制,我们首先简要介绍一下粘膜免疫系统以及循环和粘膜 IgA 的基础知识(图 1)。
粘膜免疫系统包括诱导部位和效应部位。诱导部位是幼稚 B 细胞暴露于抗原的组织,包括 Peyer 氏结(小肠和大肠)、支气管相关淋巴样组织、扁桃体和腺样体。粘膜源性抗原和 B 细胞的相互作用发生在诱导部位的生发中心。B 细胞通过 T 细胞依赖性激活(TCD)和 T 细胞非依赖性激活(TCI)两种途径被激活为 IgA 型浆细胞(PB)和抗体分泌细胞(ASC),可表达组织特异性归巢受体。这些活化的 B 细胞通过引流淋巴管进入胸导管,然后循环到肠固有层和其他粘膜上皮(效应部位)。能到达肠固有层的 IgA 型浆细胞表达趋化因子受体 CCR9(小肠归巢)和 CCR10(大肠归巢),其同源配体由各自的肠上皮细胞表达。
IgA 型浆细胞在固有层中成熟为分泌 IgA 的浆细胞,分泌由 2 个或更多个单体(IgA1 或 IgA2)组成的多聚体 IgA,这些单体通过 C-末端尾部和单个 J 链间的二硫键结合在一起。这些多聚体 IgA 能与粘膜上皮细胞的基底侧表面的多聚体免疫球蛋白受体(pIgR)结合,并被内化,然后通过囊泡进入粘膜顶端表面。受体的胞外部分(SC)被裂解并附着在多聚体 IgA(pIgA)上,以分泌型 IgA(sIgA)的形式分泌出来。
血液中的 IgA 大部分来源于骨髓,而且大都是单体 IgA1(mIgA1;IgA1 占 84%,IgA2 占 16%;单体>90%,多聚体<10%)。相反,粘膜 IgA 主要是 sIgA(>95%),有两个亚类,不同粘膜部位有不同的亚类分布。仅仅少量 sIgA 从黏膜逆行运输入血,所以 sIgA 在血循环中的浓度很低。
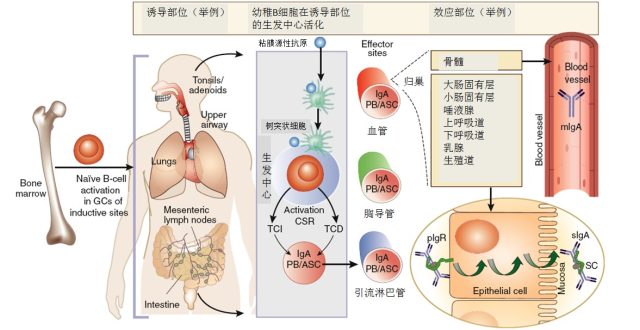
图 1 粘膜免疫系统以及粘膜及循环 IgA
原发性 IgAN 时,沉积在肾脏的半乳糖缺乏的 IgA1(Gd-IgA1)的组织来源仍存在争议,较多证据表明 Gd-IgA1 来源于粘膜。
肝脏疾病相关的 IgAN
肝病相关的 IgAN 是最主要的继发性 IgAN。尸检发现酒精性肝脏疾病继发性 IgAN 系膜区主要是多聚体 IgA1 沉积。酒精性肝硬化的患者血浆 IgA1 存在糖基化异常,失代偿性肝硬化患者糖基化异常尤其明显。
正常情况下,肝脏是循环 IgA 分解代谢的主要部位,代谢过程见图 2 。
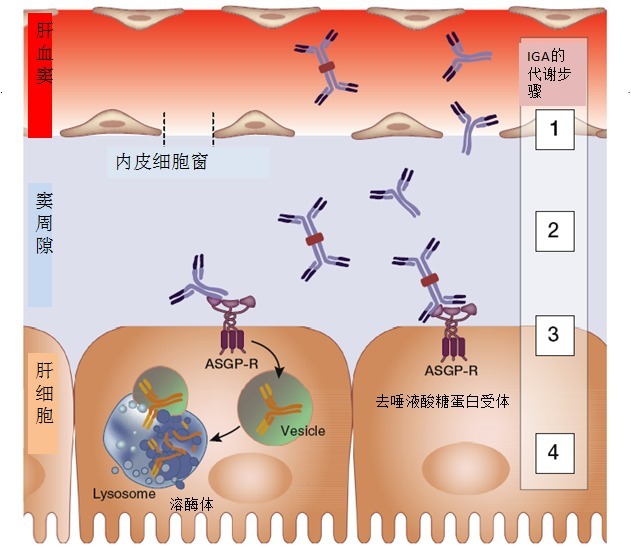
图 2 循环 IgA 在肝脏的代谢。去唾液酸糖蛋白受体(ASGP-R)表达在肝细胞的窦周隙面。它与半乳糖或 N-乙酰半乳糖胺结合。IgA 的分解代谢步骤如图所示:(1)循环 IgA 必须通过肝血窦内皮细胞进入窦周隙;(2)IgA 与肝细胞 ASGP-R 结合(依赖钙);(3)与 ASGP-R 结合的 IgA 在囊泡中内化;(4)含有 IgA(和其他去唾液酸糖蛋白)的囊泡与溶酶体融合,导致 IgA 分解代谢。
肝硬化时患者免疫球蛋白的合成增加、清除减少,血浆中总 IgA 水平是正常人的 2~4 倍,其中 25%~45% 是多聚体,在继发 IgAN 中发挥致病作用。
感染相关的 IgAN
乙肝病毒感染和 IgAN 的关系已经发现很久了,尤其是东南亚地区。肾活检发现活动性 HBV 感染的患者大约 30% 存在 IgAN,确诊 IgAN 的患者 4.2% 存在 HBV 表面抗原阳性,肾小球和小管上皮细胞可检测到 HBV-DNA。但这个发现在 IgAN 的发病机制中的作用仍未阐明。
丙肝病毒感染的患者继发 IgAN 的发生率不明。30 例丙肝肝硬化患者在肝移植时行肾穿刺活检发现有 25 例存在免疫复合物增生性肾小球肾炎,其中 7 例符合 IGAN,内皮下免疫复合物沉积比原发性 IgA 更普遍,但这 7 例 IgAN 患者有数例尿检正常,提示没有肾活检结果的情况下临床医生无法识别。有研究提示 HCV 感染继发的 IgAN 在发病机制上不同于原发性 IgAN。抗丙肝病毒治疗能否消除肾脏病变仍不明确。
IAGN(IgA 为主感染相关性肾小球肾炎)。常见于老年人和糖尿病患者。感染后 4 周左右发病。常见于皮肤或深部金葡菌感染后,较少革兰阴性杆菌感染后。临床表现有血尿、蛋白尿,急性肾损伤,低补体血症,高血压。病理生理上与原发性 IgA 不同。病理表现可看到 C3 沉积多于 IgA,KAPPA 链沉积多于或等同于 LAMBDA 链。治疗上主要是使用抗生素和支持治疗。不推荐免疫抑制剂。
粘膜炎症
多年来炎症性肠病(溃疡性结肠炎和克罗恩病)与 IgAN 的关系被反复报道。IgAN 可以在炎症性肠病发病时即被诊断,也可以在炎症性肠病缓解之后才被诊断。其中有一些患者使用柳氮磺胺吡啶和皮质类固醇治疗炎性肠病后肾活检证实系膜中沉积的 IgA 能够被清除,更进一步说明两者存在因果关系。
肠粘膜炎症导致肾小球 IgA 沉积的机制尚未阐明。目前考虑有基因因素、肠粘膜 IgA 分泌细胞增多、肠粘膜炎症部位释放的细胞因子(IL-6、IL-4、IL-10、TGF-β、B 细胞活化因子等)刺激肠粘膜 IgA 分泌。这些细胞因子可以产生系统效应,增加骨组织多聚体 Gd-IgA1 的产生。
乳糜泻患者也是 IgAN 的危险因素。不同的研究发现乳糜泻发生 IgAN 的风险增加 2-3 倍。肠道粘膜免疫的改变是共同的机制,肠道对麸质和相关肽类的渗透性增加,诱导 Gd-IgA1 生成,免疫复合物沉积在肾小球。乳糜泻并发的 IgAN 通常没有 C3 的沉积,有别于原发性 IgAN。
几种肺部疾病也与 IgAN 相关。囊性纤维化患者反复的粘膜感染导致血浆 IgA 水平升高是可能的发病机制。
自身免疫性炎症疾病
类风湿性关节炎患者 IgAN 的发病率 5%~12%。多数表现为单纯血尿或血尿合并少量蛋白尿,肾功能通常不受损。类风湿性关节炎患者血浆 IgA 水平升高,抗组蛋白 IgG 抗体糖基化异常,而 IgA1 是否有糖基化异常有待确定。
牛皮癣中重度患者发生 IgAN 的风险明显高于轻度患者(危险率 4.75)。
肿瘤
有一些少见的报道皮肤 T 细胞淋巴瘤、霍奇金病、粘膜相关淋巴组织和结外 T 细胞淋巴瘤与 IgAN 相关。大多数患者表现为血尿(偶尔肉眼血尿)、蛋白尿、肾功能不全(可能有新月体)。IgA 骨髓瘤患者血清 IgA 水平显著升高,但较少出现 IgAN 和 IgA 血管炎,除了部分 IgA1 糖基化异常的患者。
治疗
继发性 IgAN 尚没有确立最有效的治疗方案。大多数报道都建议治疗原发病,配合针对 CKD 的非特异性支持治疗。在乳糜泻和炎症性肠病的原发病治疗成功后,尿液异常和肾组织异常可得到纠正。其他类型继发性 IgA 的疗效尚没有定论,需要积累更多的经验。
总之,继发性 IgAN 的患病率很难估计,继发性 IgAN 的病理机制还没有完全阐明,需要更多的深入研究。而我们在临床上诊断 IgAN 的时候,不妨多做一些系统性检查,以发现上述潜在的原发病,针对性地治疗原发病,提高 IgAN 的治愈率和缓解率。
