在慢性肾脏病患者中,胰岛素抵抗(IR)作为心血管疾病新危险因子,参与心血管疾病(CVD)的病理生理过程。那么,IR 如何影响 CKD 患者中 CVD 的发生与发展?有什么内在机制?有什么治疗措施有助于改善 CKD 患者胰岛素抵抗呢?来自澳大利亚 Doris T. Chan 等对此进行综述,发表在最近一期的 Nephrol Dial Transplant 上。
胰岛素抵抗的定义
胰岛素抵抗 (IR) 是一种对循环中正常水平胰岛素的生物反应受损的状态,常伴有高胰岛素血症以维持血糖稳定。其以胰岛素介导的血糖处置失调、血糖利用障碍、脂质异常蓄积、脂肪细胞中脂质分解活动增加为特征。在肝脏内,葡萄糖生成增加伴肝糖原合成减少。
胰岛素对血管功能影响的作用机制
胰岛素是一种重要的血管舒张、细胞生长和蛋白代谢调节剂。其作用主要通过激活两条信号通路完成。在血管内,磷脂酰肌醇-3 激酶 (PI3K) 通路激活增加内皮一氧化碳合成酶 (eNOS) 的合成和血管舒张剂一氧化碳的生成。相反地,分裂素活化蛋白激酶 (MAPK) 通路激活增加粘附分子和血管收缩剂内皮素 (ET-1) 的产生和释放。MAPK 通路的激活同时产生负反馈信号,抑制 PI3K 通路(图 1)。 正常情况下,两条通路间相互平衡,保持血管健康。IR 将导致 PI3K 通路受损,MAPK 通路相对增强。
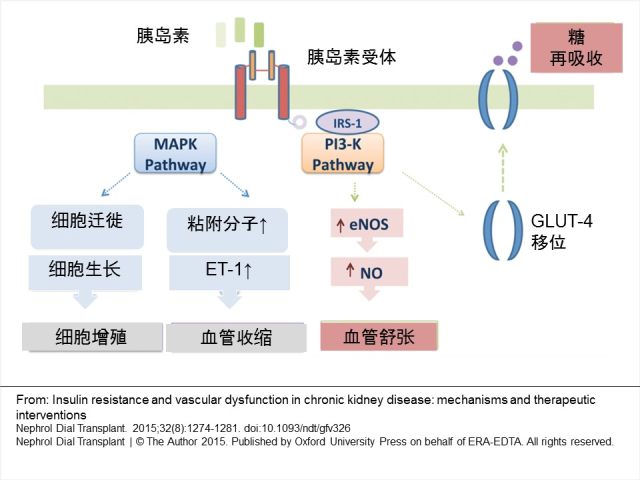
图 1 胰岛素作用对血管功能的影响机制 胰岛素受体激活通过两条信号通路调节血管紧张度。胰岛素与其受体结合后,其内部结构改变导致β亚单位的自磷酸化,包括 IRS-1 等的细胞内蛋白的磷酸化,从而激活受体。IRS-1 与 PI3-K 酶结合增加 eNOS 的合成,从而增加血管舒张物一氧化氮的生成。另一方面,MAPK 通路的激活引发粘附分子和血管收缩剂 ET-1 的释放。eNOS: 内皮一氧化氮合成酶; ET-1:内皮素-1; GLUT-4:4 型血糖转运体; IRS-1:胰岛素受体底物-1; NO:一氧化氮; MAPK:分裂素活化蛋白激酶; PI3-Kinase:磷脂酰肌醇-3 激酶
如何评估 IR
高胰岛素-正葡萄糖钳夹试验 (HEGC) 是用于直接评估 IR 的金标准。在临床和流行病学研究中,对血糖、胰岛素和脂肪因子(adipokines)的测定已经取代 HEGC,用于评估 IR。在 CKD 患者中,胰岛素抵抗评估稳态模型 (HOMA-IR) 与 HEGC 相关性良好。
IR 与 CKD 的相关作用
IR 在非糖尿病性 CKD 患者的疾病早期已经出现,并与肾功能的下降呈线性相关关系。IR 与 CKD 的相互作用存在多种可能的内在机制,包括血糖失调、尿毒症毒素增多、高血压、炎症、矿物质代谢异常、脂质代谢异常、酸中毒等(图 2)。
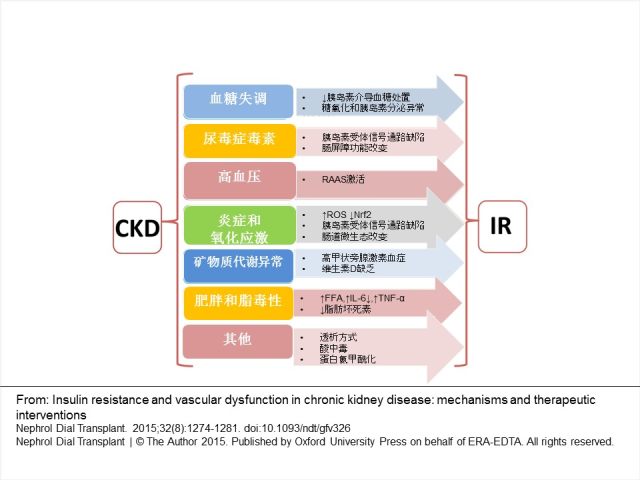
图 2 胰岛素与慢性肾脏病相关作用的可能机制 CKD:慢性肾脏病; FFA:游离脂肪酸; IR:胰岛素抵抗; IL-6:白介素-6; Nrf2: 核因子红细胞系统相关因子 2; RAAS:肾素血管紧张素醛固酮系统; ROS:活性氧簇; TNF-α:肿瘤坏死因子-α
在 CKD 患者通过改善 IR 影响血管功能的措施
生活方式改变:
减轻体重、低糖饮食、低脂饮食、减肥手术、奥利斯特 Orlistat 通过限制饮食中脂肪摄入达到减轻体重、戒烟。
药物干预:
二甲双胍、噻唑烷二酮类通过激活过氧化物酶体增生物激活受体(PPAR-γ)改善胰岛素抵抗、阿卡波糖、肠促胰岛素相关治疗、肾素-血管紧张素-醛固酮系统阻断剂、维生素 D、抗氧化剂(维生素 E、欧米伽 3 脂肪酸)
新型药物:
胆汁酸多价螯合制 (BASs)、选择性 PPAR-γ调节剂、双 PPAR 调节剂(PPAR-α/γ等)、肠道微生态调节剂(益生元等)。
胰岛素抵抗是 CKD 患者心血管相关危险因子,在血管功能的调节中起重要作用。非药物和药物干预通过调节胰岛素抵抗,改善血管功能,可能有助于减少 CKD 患者心血管相关结局的发生。需要更多大型、硬终点的临床研究确定相关减少胰岛素抵抗的干预措施对 CKD 患者心血管相关结局的影响。
