CKD 领域发展的关键是提高 CKD 的识别、减少 CKD 危险因素的发生和影响,提高对于 CKD 发生发展的认识,改善预后,设计并验证新的治疗策略。事实上,国际肾脏病协会(ISN)已经发起了关于 CKD 的全球倡议,指出了 CKD 的认知局限,指明了未来的解决方向。这里,我们对一些最有前景的领域展开讨论。
遗传性肾脏疾病导致 CKD
新一代测序研究揭示肾脏疾病有明显的遗传异质性。目前发现激素抵抗型肾病综合征可能与 40 多种不同的基因有关。我们应该在肾穿刺的基础上结合更多的基因诊断,从而进行个体化的诊断和治疗。
肾病的遗传倾向研究近十年来取得重大进展。全基因组筛查和相关研究已经可以识别基因易感变异,绘制了风险位点。随着我们对健康和疾病状态下肾脏功能受遗传因素影响的进一步理解,CKD 遗传形式的研究将呈指数级增长。
CKD 管理的生物学标志物
某些生物学标志物可以预测 CKD 的进展,使用这些标志物早期识别 CKD 可以帮助我们启动肾保护的干预措施。最引人注目的是关于肾单位数量的生理学标志。确定出生时的肾单位数量能识别肾单位先天减少的个体,也能有助于分析后期肾单位减少是损伤引起的还是生理退化引起的。这样的标志物可用来识别 CKD G2 期的患者,也能作为临床试验的终点指标来量化评估肾保护作用和药物毒性。
然而,到目前为止,我们还没有在血液或尿液中成功地找到临床可以应用的反映肾单位数量的生物学标志物。此外,生物学标志物无法鉴别残留肾单位有没有代偿性肥大。而已经有一些影像学研究通过使用示踪剂或者通过结合影像结果和肾穿刺结果来估计肾小球数目或者单个肾小球的滤过率,是很有希望的策略。
肾单位丢失和 CKD 进展的触发因素
我们仍然很难确定肾单位先天减少、肾单位损伤、创伤愈合(间质纤维化)和代偿性高滤过这些因素在 CKD 发生发展中的影响权重。甚至,对于纤维化本身是否导致肾单位的损失仍有争议,目前有几个研究正使用抗纤维化药物来验证这个问题。接下来的研究仍应集中在寻找这些因素对 CKD 影响的确切证据以及个体化地选择性地针对治疗。
延缓 CKD 进展
延缓 CKD 进展的手段除了抗纤维化外,小样本研究发现降尿酸治疗也很有希望,我们期待正在进行的多中心试验公布结果。此外,随机对照研究发现巴多索隆(bardoxolone Nrf2 激活剂)和叶酸有剂量相关性的肾保护作用,然而作用机制不明。
肾发生和肾再生
由于进行肾移植相当困难,受损肾单位的再生研究正在进行。肾单位再生能力的生理研究和病理生理研究如火如荼。
数个研究已经找到防止 AKI 和 CKD 肾单位丢失的药物靶点。比如,针对足细胞的祖细胞即壁层上皮细胞治疗,促进其分化成功能性足细胞,阻止其过度增殖、产生基质,可以促进肾小球疾病的缓解。此外,还有针对肾小管上皮细胞的治疗,促进其增殖,提高肾小管再生能力,减少 AKI 后 CKD 的发生。尽管实验研究结果可喜,目前仍没有相关的临床研究。少数几个早期临床试验(I-II 期)试图通过抑制适应不良性修复来减少 CKD 肾单位的丢失,抗纤维化药物也正在进行临床试验。
再生医学也开始探索治疗肾脏疾病。间充质基质细胞(MSCs)是一组容易获得的特征明确的细胞,在 CKD 的实验模型研究中可以改善肾结构、提高肾功能。MSCs 有免疫调节和旁分泌作用,可释放微泡和/或外泌体,将基因、microRNA、蛋白传递给受体细胞。目前正在进行早期临床研究。同样,大量试验研究报道在 AKI、CKD 的多种老鼠模型中注射肾脏祖细胞并激活可以改善肾脏结构和/或功能。然而,把临床前研究转化成有力的、有效的、安全的临床治疗的研究仍然有限。
最后,肾脏的「类器官」也已经开发出来。「类器官」是从人多能干细胞和胚胎干细胞诱导分化出来的 3D 器官芽。这些「类器官」在体外模仿体内器官,包含多种肾脏细胞类型。「类器官」能用来研究人类疾病和在体外测试药物毒性,尤其是结合了基于 CRISPR-Cas9 的基因编辑技术。然而,肾脏结构和功能的复杂性远远超过了「类器官」,它还不能用于临床。能否在实验室制造出真正的肾脏器官仍然存疑。
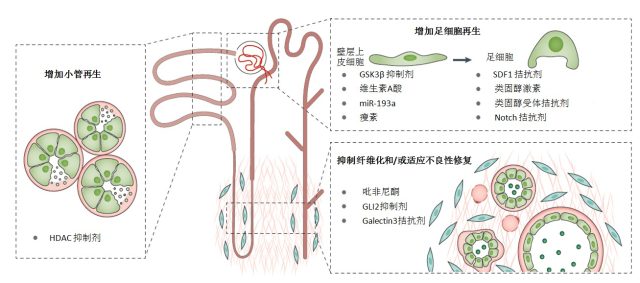
图 9 肾脏再生的靶点。未来,针对肾脏再生和适应不良性修复的靶点治疗可以减少肾单位的丢失、保护残余肾单位。最有发展前景的方向包括增加足细胞再生(使用 GSK3β抑制剂、类固醇激素或类固醇受体拮抗剂来促进壁层上皮细胞祖细胞分化成足细胞和/或阻止壁层上皮细胞过度增殖)、抑制成纤维细胞增殖来抑制纤维化和/或适应不良性修复(使用抗纤维化药物吡非尼酮、GLI2 抑制剂、纤维化介质半乳糖凝集素 3 拮抗剂)、增加小管再生(使用 IL-22 或 HDAC 抑制剂增强肾小管细胞增殖能力)。HDAC:组蛋白脱乙酰酶;GSK3β:糖原合成酶激酶 3β;miR:microRNA;SDF1:基质细胞衍生因子 1;GLI2:胶质瘤相关的癌基因转录因子 2。
减少心血管疾病发病率和死亡率
关于 CKD 的心血管疾病发病率和死亡率,我们仍需要更多的、严格的动物和人体研究来确定适合干预治疗的分子靶点。对于这个迫在眉睫的问题,我们有一些潜在的新的解决办法,如调节脂质转运来控制高血脂(使用前蛋白转化酶枯草溶菌素 9 抑制剂),抑制全身炎症(使用新的抗炎药比如补体抑制剂),调节肠道微生态(使用益生菌限制微生物相关的全身炎症和代谢失衡),干扰血管钙化和心脏纤维化(使用维生素 K 类似物)。
动物模型
人类基因型和表型的明确定义、分子靶点的确立,可以使转化研究和临床试验更好地联系起来,产生创新的方法,进而在动物模型中验证。选择的动物模型应能够重现人类 CKD 进展,并且在后续的临床试验中能使用相同的终点。包括与人类疾病具有相同致病突变的小鼠、免疫系统人源化的小鼠或高级动物模型(比如猪、非人灵长类),这些模型能缩小临床前试验和临床试验间的差距。
临床试验设计
肾脏病学临床试验失败的主要原因之一是患者的异质性。实际上,成人 CKD 可能是好几种致病因素经时间累积后的结果,比如 APOL1 或 UMOD 基因变异(改变 CKD 进展)、肾单位先天减少、AKI 发作史。因此 CKD 临床试验设计的时候针对同质的亚组患者进行分析很有必要,这样有针对性的临床试验需要的样本较少,也增加了个体化治疗的可行性。
以下几个方面可以改善临床试验的设计:重新考虑以组织学特征命名而找不到病因的疾病类型(比如 FSGS)、避免在设计中纳入多重作用机制的药物、根据生物标志物谱预先选择患者、设计的研究终点能更好地预测 CKD 进展至 ESRD。
例如,为了测试补体 5a 受体抑制剂 avacopan 在 ANCA 相关性血管炎患者的疗效,CLEAR 试验没有使用通常的标准治疗方案,而是设计了在环磷酰胺或利妥昔单抗的基础上比较 avacopan+低剂量激素和安慰剂+高剂量激素的方案。这个策略帮助设计者证明在治疗血管炎时 avacopan 能有效地替代高剂量糖皮质激素。
前沿科学转化成实践应用
解读肾穿刺(病理)结果、评估实验室诊断和整合基因检测都变得日益复杂,需要有足够资源的卓越的临床中心才能满足需求。实施前沿的、昂贵的治疗方案需要高水平的专业知识,患者的正确选择对于确保获益日益重要。
对患者和全科医生进行继续教育,让他们了解越来越多的价格合理的治疗方案,比如合并有 CKD 的糖尿病患者可使用钠葡萄糖协同转运蛋白 2(SGLT2)抑制剂。
最后,让公众、医疗服务提供者、医疗政策制定者有意识地为实施标准治疗提供重要支持。KDIGO 制定的全球实践指南内容从 CKD 分期的定义到 CKD 并发症的管理标准均有涉及,已经成为实践的重要工具,当然还必须进一步完善和改进。
