膜性肾病(MN)是成人肾病综合征(NS)的常见病因。来自美国哥伦比亚大学医学院肾脏科的 Andrew S. Bomback 教授和来自美国梅奥诊所肾脏和高血压科的 Fernando C. Fervenza 教授在 American Journal of Nephrology 杂志上发表综述,聚焦于 MN 的发病机制和治疗方法。
原发性和继发性 MN
75%MN 患者足细胞上有 M 型磷脂酶 A2 受体(PLA2R)抗原,机体中存在针对 PLA2R 的抗体。另有 5%PLA2R 抗体阴性的患者体内可能存在针对另一种足细胞抗原-血小板反应素-1 型 7A 域(THSD7A)的抗体。总计起来,大约 80% 的 MN 患者都有直接针对某个明确的特异性足细胞靶抗原的抗体,这些患者被认定为原发性 MN。
大约 20%~25% 的 MN 患者是继发于自身免疫性疾病、恶性肿瘤、感染、药物(如:金制剂、青霉胺、非甾体类消炎药)或其他尚未明确的自身抗体。
3 项不同白人人群的特发性 MN 患者的单核苷酸多态性的全基因组关联研究,明确了与特发性 MN 相关的 2 个基因座的等位基因:含有编码 PLA2R 基因的 2q24 染色体和含有编码 HLA-DQA1 基因的 6p21 染色体。基因型和表型的相关性显示携带高风险 HLA- DQA1 和 PLA2R1 单倍型基因具有更高的循环抗 PLA2R 抗体的患病率。
抗 PLA2R 抗体作为预后判断和治疗应答的标志物
有许多证据显示抗 PLA2R 抗体与疾病的活动程度有关,能为疾病的严重程度提供预后信息,能作为评估治疗有效性的有用的生物标志物。
抗体滴度低的患者较抗体滴度高的患者自发缓解的发生率更高。高抗体滴度与对免疫抑制治疗应答率较低和缓解时间较长有关。复发率还与临床缓解时的抗体水平有关,免疫抑制治疗结束时抗 PLA2R 抗体阴性的患者较 PLA2R 抗体仍然阳性的患者复发率低。PLA2R 抗体的水平还可以用来预测蛋白尿从亚肾病综合征范围向肾病综合征范围的进展。
总的来说,肾活检标本中 PLA2R 染色的强度和循环中抗 PLA2R 抗体的水平强烈相关。但是,在诊断 PLA2R 相关性 MN 时,肾小球中 PLA2R 染色较循环抗 PLA2R 抗体更敏感。
MN 的治疗
1. 初始的保守治疗:诊断为 MN 的患者应该接受直接针对降低血压、减轻水肿、减少心血管事件风险因素和减少血栓形成的保守治疗。
对于液体潴留和水肿形成的机制目前有新认识。在肾小球渗透性增加的情况下,血清纤溶酶原异常地过滤到尿液中,继而被尿激酶型纤溶酶原激活剂转化为活性纤溶酶。活性纤溶酶随后降解阿米洛利敏感的 Na+通道γ亚基的抑制肽,增加 Na+的重吸收。这些发现提示,Na+通道阻断剂阿米洛利联合应用袢利尿剂和噻氢类利尿剂可能是有效控制水肿的方法。
血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻断剂(ARB)都推荐用于控制血压。由于其肾脏保护作用和降蛋白尿作用,这两类药物优于其它种类降压药。但是其降蛋白尿作用与治疗前基线值相比,不太会超过 30% 这一临界点,尤其是在蛋白尿水平>10 g/d 的患者中。而这些患者是 疾病进展高风险的患者,不太可能从 ARB 单药治疗中获益。
高胆固醇血症的患者也应该接受他汀治疗。在表现为 NS 的 MN 患者中还应该考虑预防性抗凝治疗,尤其是血清白蛋白水平<22 g/L 的患者,这些患者动脉和静脉血栓性事件的风险很高。
传统观点认为,保守治疗应该持续至少 6 个月,除非肾功能恶化或发生致命的 NS。如果初始的保守治疗不完全有效,那么考虑采用以下几种措施来治疗 MN 患者。
2. 烷化剂(环磷酰胺或氯苯丁酯)联合糖皮质激素:Ponticelli 等人的方案证实,在表现为 NS 的 MN 患者中,6 个月烷化剂交替的周期性方案(环磷酰胺或氯苯丁酯)联合静脉冲击或口服糖皮质激素能有效达到缓解。然而,这一方案的累积风险包括:机会性感染、性腺损伤(精子生成缺乏症、卵巢功能衰竭)、出血性膀胱炎(仅限环磷酰胺)、肿瘤(骨髓增生异常综合征、急性髓细胞性白血病、膀胱移行细胞癌、输尿管或盆腔炎)和中毒性肝炎。
最近一项使用激素和环磷酰胺 6~12 个月的试验显示,严重的不良反应在使用免疫抑制方案的患者中发生率更高。使用环磷酰胺的患者住院率、感染事件、骨髓和肝脏毒性、心血管和血栓事件较保守治疗组更高。虽然此研究中 12 个月里环磷酰胺的累积剂量达到 36~46 g,远高于 Ponticelli 等人的方案,但即使将研究对象仅限于环磷酰胺的累积剂量<20 g 的患者,这种严重不良事件的风险仍然存在。而且,即使环磷酰胺累积剂量 12 g,也与恶性肿瘤的风险增加有关。
在治疗 MN 的两种烷化剂中,环磷酰胺优于氯苯丁酯。为了将随后发生恶性肿瘤的风险降至最小,推荐保持总的环磷酰胺累积剂量<20 g。
3. 钙调磷酸酶抑制剂单药治疗:钙调磷酸酶抑制剂在 MN 患者中常常被用到,这类药物具有显著的降蛋白尿作用,机制尚不完全清楚。最近的研究发现,抑制钙调磷酸酶活性能稳定细胞骨架结构,改善裂孔功能。预实验显示,在细胞内钙离子增加的情况下,钙调磷酸酶能刺激足细胞足突形成的骨架蛋白 synaptopodin 的降解。此外,最近的研究还提示钙调磷酸酶调节裂孔蛋白的表达和功能,包括 nephrin 和 ZO-1。
但似乎这些效应的临床意义不大,因为 MN 患者在肾移植后服用钙调磷酸酶抑制剂作为维持治疗,但仍有可能出现大量蛋白尿的临床复发。这种情况在另一种原发性足细胞病-局灶节段硬化性肾小球病(FSGS)中也会发生。
钙调磷酸酶抑制剂是有效的,可以作为 MN 患者诱导缓解的单药治疗,但是一旦停药,复发率较高,因此许多患者成为钙调磷酸酶抑制剂依赖患者,需要长期使用钙调磷酸酶抑制剂,这将显著增加肾毒性的风险。就在最近,英国一项 RCT 试验的结果发现环孢霉素和保守治疗相比,并未有长期获益。
4. 吗替麦考酚酯(MMF):不推荐将 MMF 单药治疗作为 MN 患者的一线治疗。
与环磷酰胺 1.5 mg/kg/d 联合间断甲强龙和隔天泼尼松治疗 12 个月相比,MMF 联合大剂量糖皮质激素作为 MN 患者(64 位)的短期治疗似乎有效。第 12 个月时,66% 使用 MMF 的患者和 72% 使用环磷酰胺的患者蛋白尿缓解,两者差别未达统计学显著性差异。12 位 MMF 治疗的患者(38%)经历了复发,9 名(31%)停止了治疗。
随后的一项 RCT 试验证实,12 个月时,保守治疗(RAS 阻断剂、他汀类药物、低盐低蛋白饮食和利尿剂)联合 MMF 治疗并不比单用保守治疗降蛋白尿或增加完全或部分缓解率的效果好。
在 MN 患者中解决未满足的需求
1. 在 MN 中靶向 B 细胞的治疗:环磷酰胺的治疗能降低 B 细胞活性。动物研究进一步显示,干扰 B 细胞活化的药物对肾小球肾炎具有保护作用。然而,正如上文所讨论的,以环磷酰胺为基础的治疗方案与显著的毒性和恶性肿瘤的长期风险有关。因此,长久以来都希望找到一个毒性较小但同样能有效治疗 MN 的药物。在上个世纪 90 年代晚期,针对 B 淋巴细胞上的 CD20 抗原的基因工程抗体的出现,提供了一种新的靶向治疗,能够快速持久的削减和消耗外周和组织中的 B 淋巴细胞。这也为这些药物治疗 MN 打下了基础。
1.1 利妥昔单抗治疗 MN:利妥昔单抗是针对 CD20 的小鼠/人 IgG1κ嵌合的单克隆抗体。CD20 是表达在未成熟、成熟和活化 B 细胞表面的抗体,但是不表达在干细胞或长寿命的浆细胞上。利妥昔单抗通过抗体依赖细胞介导的细胞毒性(ADCC)、补体依赖的细胞毒性和凋亡途径削减 B 细胞。
利妥昔单抗的安全性是非常显著的。最近一项回顾性分析比较了任何不良事件和严重或非严重不良事件的发生时间,证实在 MN 患者中利妥昔单抗可以成为替代激素联合烷化剂的一线免疫抑制治疗方案。利妥昔单抗治疗 MN 的有效性和安全性目前有 2 项正在进行中的 RCT 进行评估。
MENTOR 试验(NCT01180036)是一项开放标签、随机对照研究,在原发性 MN 患者中比较利妥昔单抗(Day1 和 Day15 时 1 g IV,随后在第 6 个月时重新治疗)和环孢霉素(3.5-5 mg/kg/d,治疗 12 个月)在诱导缓解和维持缓解方面的有效性和安全性。治疗的有效性通过 24 个月时的缓解状态(基于蛋白尿水平的变化)来评估。研究将在 2017 年 9 月结束,结果有待公布。
STARMEN 试验(NCT01955187)将会评价他克莫司单药治疗 9 个月(初始剂量 0.5 mg/kg/d,调整直至血药浓度达到 5~7ng/ml 持续 6 个月,在开始他克莫司剂量递减前的第 180 天用单一剂量的利妥昔单抗 1 g IV),随访 2 年,观察缓解率、复发率、肾功能维持率和不良反应。
2. 促肾上腺皮质激素治疗 MN:在 MN 患者中评估了促肾上腺皮质激素(ACTH)的有效性,不断增加的证据都支持其在 MN 患者中的有效性。
(1)合成的 ACTH 类似物:在有肾脏疾病的患者中使用 ACTH 类似物(1 mg,每周 2 次)治疗 2~11 个月,持续使用直至患者出现持续的蛋白尿缓解。在另外 23 名蛋白尿相关疾病的患者,如 MCD、原发性 MN、FSGS、膜增生性肾小球肾炎、糖尿病肾病或遗传性肾病患者中使用 ACTH 类似物治疗,被证实蛋白尿显著而持久的缓解。
在一项非劣性试验中,比较了使用合成的 ACTH 类似物治疗 12 个月和使用环磷酰胺或氯苯丁酯与甲强龙交替治疗 6 个月的疗效。纳入了 32 名肾活检证实的 MN 患者(临床表现为 NS)。在经过中位 24 个月的随访后,16 名使用 ACTH 类似物的患者中有 14 名达到完全或部分缓解,而 16 名使用细胞毒药物联合甲强龙的患者中仅有 12 名达到完全或部分缓解。最后一次随访时,ACTH 类似物治疗组蛋白尿的中位水平从 5.1 g/d 降至 2.1 g/d,细胞毒药物联合甲强龙治疗组蛋白尿的中位水平从 6.0 g/d 降至 0.3 g/d。
(2)天然的 ACTH 凝胶:最新的研究显示:天然的 ACTH 凝胶(通常 80U 皮下注射,一周两次,持续 6 个月)能有效地治疗原发性 MN。
一项前瞻性研究中,20 名肾活检证实为原发性 MN 的患者接受了 40U 或 80U 的 ACTH 凝胶皮下注射,每周 2 次,持续 12 周。ACTH 治疗结束时,50% 患者的蛋白尿水平降低>50%,随访 1 年时,65% 患者的蛋白尿水平降低>50%。整个队列人群的蛋白尿水平都有显著改善,平均降低 3.87 g/d。80U 的剂量优于 40U 的剂量。在 12 周治疗结束时,40U 剂量组没有患者出现有临床意义的蛋白尿改善。与此相反,11 名使用 80U 剂量的患者中有 5 名尿蛋白降低幅度 ≥ 30%。
总的来说,来自欧洲的使用合成 ACTH 类似物的临床试验和在美国开展的天然 ACTH 凝胶的研究都支持这种治疗对 MN 患者以及其它导致 NS 的肾脏疾病患者的有效性。更重要的是,这种药物在对其它治疗抵抗的患者中显示出有效性。结果同时也强调了需要足够长的随访时间(超过 6 个月)来评估治疗的反应性并调整治疗。
膜性肾病的潜在治疗方法
1. 由于有些 B 细胞对利妥昔单抗治疗抵抗,因此出现了第二代(obinutuzumab,奥匹妥珠单抗)和第三代抗 CD20 单抗(ofatumumab,阿法单抗),它们结合在 CD20 分子的不同抗原表位上。预实验显示 ofatumumab 在对利妥昔单抗抵抗的患者中有效。
2. 靶向于 B 细胞淋巴刺激因子的贝利木单抗(Belimumab)可能诱导自身反应性 B 细胞的凋亡。在一项纳入 14 名抗 PLA2R 抗体阳性的 MN 患者的研究中,予以贝利木单抗治疗显著地降低了抗 PLA2R 抗体的水平、减少了蛋白尿、使血清白蛋白水平正常。
3. 抗 CD20B 细胞的靶向治疗失败可能是由于浆细胞产生抗体,因为这些细胞没有 CD20 分子,因此不被利妥昔单抗所削减。硼替佐米是一种蛋白酶体抑制剂,在抗中性粒细胞胞浆性抗体(ANCA)相关性肾炎的动物模型中被证实能削减自身反应性浆细胞,减少 ANCA 和 dsDNA 抗体的滴度,可考虑作为难治性 MN 的治疗。
硼替佐米的使用与显著的毒性有关,但是第二代蛋白酶体抑制剂(如 delanzomib 德兰佐米和 carfilzomib 卡非佐米)疗效相同但是安全性改善,目前也已上市。还需要研究这些新型的蛋白酶体抑制剂是否对抵抗性 MN 有有益影响。
4. 补体本身也是 MN 治疗的另一个潜在靶点。未发表的一项试验,纳入了 117 名 MN 患者,使用 eculizumab(埃库珠单抗)治疗(8 mg/kg,每 2 周或每 4 周一次,持续 4 个月)。然而,由于埃库珠单抗剂量不足,该研究未能有效地抑制补体。新的补体抑制剂包括口服制剂现已上市,在将来的临床试验中需要进行评估。
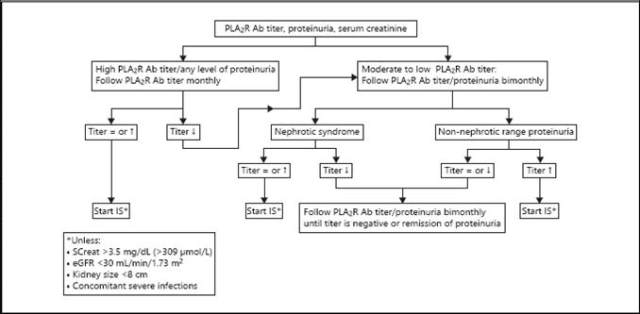
图 1 膜性肾病的预后预测方法
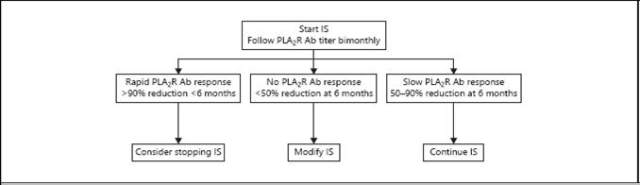
图 2 膜性肾病的治疗方法
全文总结
免疫抑制治疗,包括糖皮质激素与烷化剂交替,和钙调磷酸酶抑制剂可以部分成功地减少蛋白尿,但其应用也有显著的不良反应和较高的复发率。新型的干预措施,包括:靶向 B 细胞的利妥昔单抗和促肾上腺皮质激素(ACTH)治疗正在研究之中。
了解治疗靶点和新的生物标志物的可获得性有助于诊断和改善 MN 的风险分层,也可能有助于用更广泛的治疗方案对 MN 患者进行个体化治疗。相当多的证据支持使用 B 细胞削减法作为 MN 患者的初始治疗。对传统治疗(如烷化剂和钙调磷酸酶抑制剂)无应答的患者可以考虑使用 ACTH。
