近年来,化疗、免疫调剂治疗、造血干细胞移植和固体器官移植的出现已彻底改变了恶性肿瘤、自身免疫性疾病和终末期器官衰竭患者的管理。总的来说,这些干预措施可能导致这些人群发生感染风险的几率增加。
21 世纪初, BCR-ABL 酪氨酸激酶抑制剂伊马替尼已经证实了治疗慢性髓细胞性白血病和胃肠间质瘤的有效性和安全性。此后,治疗治疗恶性肿瘤和自身性免疫疾病的新的作用机制的药物(如单克隆抗体、小分子激酶抑制剂)逐渐在临床应用中呈指数样的增长。此外,新型细胞疗法,如嵌合抗原受体(CAR)细胞在治疗难治性恶性肿瘤中也显示出良好的前景,应用也越来越广泛。
这些生物和细胞治疗因为对于建立保护性先天和适应性免疫反应有至关重要作用的免疫相关分子和途径有一定的抑制作用,与随之而来的感染相关。在此,我们简要概述了某些生物和细胞疗法的背景下,有关感染敏感性指标升高的主要观察结果。
单克隆抗体相关的感染并发症
单克隆抗体相关的感染并发症总结于表 1。
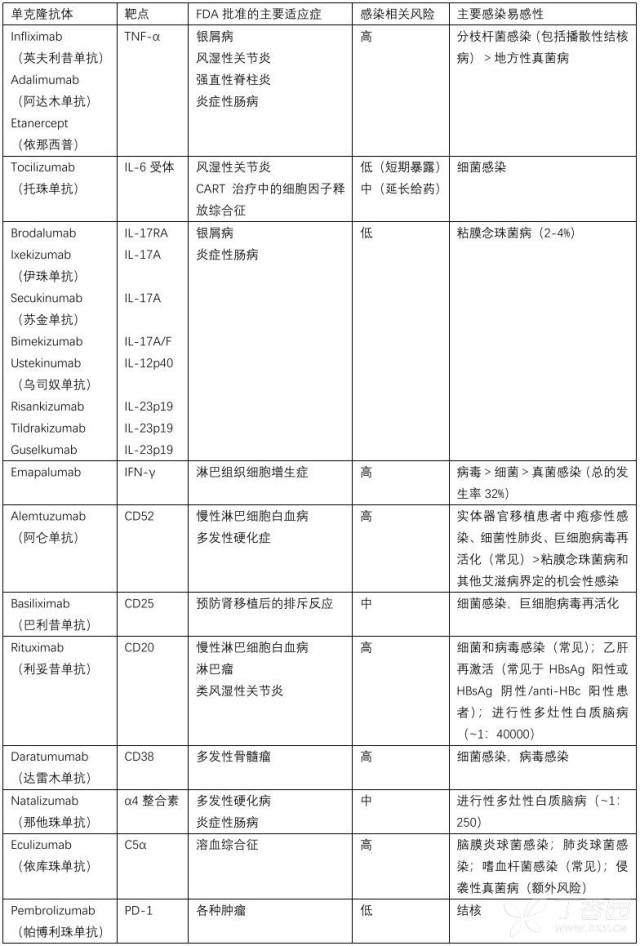
2001 年,在接受 TNF-α 抑制剂英夫利昔单抗的患者中,报告了结核病,这个报告首次揭示了单克隆抗体和感染易感性之间的联系——通常是肺外(包括播散性结核病)。TNF-α 抑制剂现在已被公认易感分枝杆菌,较少情况下感染特定的真菌(组织胞浆菌病),这与 TNF-α 在启动巨噬细胞内病原体清除中的关键作用一致。与全人可溶性受体融合蛋白 TNF-α 受体依那西普相比,单克隆抗体英夫利昔单抗和阿达木单抗的感染风险更大,建议在开始抗 TNF-α 治疗前筛查潜在结核。
自从 TNF-α 抑制剂抑制剂临床应用之后,其他细胞因子靶向单克隆抗体也逐渐进入临床使用,不同的单克隆抗体特异性感染风险有所不同。例如,IL-1 相关信号通路的抑制剂如 IL-1b 靶点抑制剂 canakinumab 和 IL-1 靶点抑制剂 anakinra,总体耐受良好。在没有其他危险因素的情况下。对 IL-6 受体信号传导的抑制作用的托珠单抗在反复接受治疗的风湿性疾病患者中有增加严重细菌感染的风险,在短期接触的患者中(在 48 h 内接受 1-2 剂量)耐受性良好,在长期使用患者中,也有零星的机会性真菌感染的报道,特别是在联合了免疫调节剂皮质类固醇激素的患者中。
最近进入临床的靶向 IL-17 受体的单克隆抗体(如 IL-12p40、IL-12p19、IL-17A、IL-17A/IL-17F、IL-17RA)用于治疗银屑病和炎症性肠病,与 2~4% 的患者患有难治性粘膜念珠菌病有关,这也与已知的完整的 IL-17 信号通路可以提高粘膜抗真菌能力是一致的。早期的临床实践显示 GM-CSF 受体靶向单克隆抗体马夫利列单抗(mavrilimumab)与肺炎的风险增加有关,而 IFN-γ-靶向的单克隆抗体 emapalumab 可能与严重细菌感染(包括菌血症、肺炎、败血症和坏死性筋膜炎)、分枝杆菌、特定的真菌感染、耶氏肺孢子菌感染(PJP)、病毒(特别是带状疱疹病毒,总的发生率 32 %,FDA 也提到)的风险增加有关。因此,对接受 emapalumab 治疗的患者应筛选潜伏结核病,并且考虑抗病毒和抗真菌预防。
除了细胞因子靶向单克隆抗体外,其他靶向或消耗淋巴细胞的单克隆抗体也可能增加感染风险。例如,靶向 CD 52 的单克隆抗体阿仑单抗影响 T 细胞淋巴细胞减少可能长达 3-5 年。接受阿仑单抗治疗的患者发生细菌性肺炎(频率>5-10 %)和单纯疱疹病毒和带状疱疹病毒的病毒激活的风险很高。因此,建议在开始使用阿仑单抗之前患者应接种肺炎球菌和带状疱疹疫苗,在使用阿仑单抗的个体中,应强烈考虑使用伐昔洛韦预防。此外,在器官移植患者中,考虑使用阿仑单抗预防排斥反应容易发生巨细胞病毒的再激活,通常是在移植后一年内(发生频率为 5-15 %,取决于患者群体)。在接受巴利昔单抗 basiliximab 治疗的器官移植患者中也可观察到 CMV 和 BK 病毒的重激活,巴利昔单抗 basiliximab 是一种单克隆抗体,它针对活化的 T 细胞的 IL-1 受体的 CD 25,但对比阿仑单抗或抗胸腺细胞球蛋白,发生风险似乎相对较低。接受阿仑单抗治疗的患者也可能有 AIDS-相关性感染的发生,如粘膜念珠菌病,PJP、进行性多灶性脑白质病(PML),隐球菌病,弓形体病,而在阿仑单抗治疗的早期,也有李斯特菌病和结节病的散发病例的报道。因为高危人群中肺结核和人乳头瘤病毒有再激活的风险,所以建议在阿伦单抗使用之前接种 HPV 疫苗,进行潜伏性结核的筛查。最后,除了考虑使用伐昔洛韦进行预防以外,对于患者人群不同或共存的危险因素不同,可考虑使用氟康唑和/或复方磺胺甲恶唑进行预防。
以 CD 20 为靶点的单抗利妥昔单抗会导致 B 细胞消耗时间延长和低丙种球蛋白血症,从而诱发严重的细菌和病毒感染。CD 38 靶向单抗达雷木单抗 daratumumab 消耗浆细胞和浆母细胞,也可能导致低丙种求蛋白血症,导致类似的感染发生。最近的一项研究表明,利妥昔单抗治疗前或治疗期间 IgG 水平下降与严重感染的发展有相关;因此,对接种疫苗反应不充分的利妥昔单抗患者应考虑监测丙种球蛋白水平和免疫球蛋白替代治疗。重要的是,利妥昔单抗是乙型肝炎再激活的主要危险因素,可导致暴发性肝功能衰竭和死亡;因此,建议对高危人群(HBsAg 阳性或 HBsAg 阴性/抗 HBc 阳性)进行预防。在以 a4-整合素为靶点的纳他珠单抗也有进行性多灶性脑白质病的发生(频率 1:250),通常在长期(>2 年)用药后发生,同样也可能在在抗坎宁安病毒抗体阳性和/或接受额外免疫抑制药物治疗的个体中发生。利妥昔单抗也使 PJP 的易感性增加,亦有严重西尼罗脑炎和巴贝斯虫病的报道。
与其他遗传性晚期补体缺陷的患者的易感性相比,补体 c5a 靶向单抗依库珠单抗 eculizumab 可能导致危及生命的脑膜炎球菌病、感染肺炎球菌、淋病和嗜血杆菌的风险增加 1000-2000 倍,因此,在使用依库珠单抗之前进行疫苗接种是极其重要的。2018 年,FDA 更新了依库珠单抗的警告,增加了曲霉病的风险,特别是在有额外因素诱发曲霉病的患者中。同样的,在依库珠单抗治疗伴有血栓性微血管病的造血干细胞移植的受者中报道,有 20 % 的患者发展为曲霉病,尽管他们都接受了中等活性的抗真菌药物的预防。需要更多的研究来探讨在依库珠单抗治疗的患者中如何区分发生真菌病的风险。
靶向免疫检查点(PD-1,CTLA-4)的抑制剂改变了肿瘤治疗的进展,除了最近的报道认为免疫检查点抑制剂可能使结核病易感或暴露以外,似乎并不引起其他感染的易感性。事实上,早期临床实践报道了免疫检查点抑制剂在难治性感染(如 PML、毛霉菌)中的潜在应用。然而,免疫检查点抑制剂相关的免疫相关不良反应事件频繁发生,在处理不良事件时使用的免疫调节剂如皮质类固醇激素或 TNF-α 进行处理也容易导致机会性感染。
小分子激酶抑制剂相关的感染并发症
小分子激酶抑制剂相关的感染并发症总结于表 2。
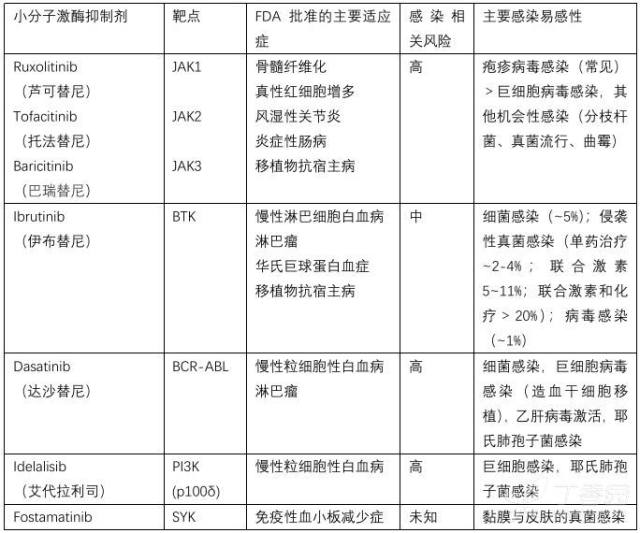
酪氨酸激酶抑制剂(鲁索替尼 ruxolitinib,托法替尼 tofacitinib,巴瑞替尼 baricitinib,乌帕替尼 upadacitinib)在临床实践中越来越多,在临床试验注册官网上有超过 300 项正在进行的临床试验评价其在多种自身免疫性疾病、炎症和恶性肿瘤疾病中的疗效。这些药物能有效地控制 JAK/STAT 通路和减少信号下游的几个炎症介质,包括常见的 γ-系列的因子,I 型、II 型和 III 型干扰素、GM-CSF、IL-6、IL-12、IL-22 和 IL-23。不足为奇的是,接受 JAK 抑制剂治疗的患者有患细菌性肺炎、严重病毒感染包括单纯疱疹、带状疱疹和巨细胞病毒疾病的风险。因此,对于接受 JAK 抑制剂的患者强烈推荐使用伐昔洛韦进行预防。此外,与 IFN -γ 产生淋巴细胞和巨噬细胞之间的串扰在清除细胞内病原体方面的关键作用保持一致,JAK 抑制剂与分枝杆菌(结核和非结核)、特异性真菌、隐球菌和 PJP 的感染发展相关。因此,当其他危险因素同时存在时,使用 JAK 抑制剂治疗患者应考虑 PJP 预防。此外,需要认识到 JAK 抑制剂治疗的患者曲霉病的发展,特别是当其他免疫调节剂同时使用时;事实上,曲霉病的零星报道正在出现,这与小鼠动物实验证据一致,即 IFN-l/IFNLR1/JAK/STAT 信号可以促进中性粒细胞氧化破裂和杀死曲霉菌。
布鲁顿酪氨酸激酶(BTK)抑制剂伊布替尼 ibrutinib 会影响 B 细胞的发育,存活和激活,已经成为改变了慢性淋巴细胞白血病和其他 B 细胞恶性肿瘤患者治疗的药物。接受伊布替尼治疗的患者有 6 % 发生细菌感染,主要是菌血症和肺炎。最近一家三级癌症中心显示葡萄球菌是最常见的致病菌。考虑到伴 X 染色体遗传的无丙种球蛋白血症的患者接受伊布替尼治疗,发生侵袭性真菌感染的风险很低,所以伊布替尼治疗后出现侵袭性真菌病具有重要意义。伊布替尼治疗后侵袭性真菌感染(主要是曲霉菌)更为常见,其次是 PJP,再次是隐球菌感染。除了抑制 B 细胞和骨髓细胞中的 BKT,还能抑制 T 细胞的 ITK,可能促进依赖 T 细胞免疫的 PJP 或隐球菌的感染的发生。最近的报告都表明伊布替尼单药治疗在 2-4 % 的患者中与曲霉菌病相关,伊布替尼联合糖皮质激素后,发生率约为 5~11 %,伊布替尼联合糖皮质激素和化疗后发生率大大增加,可能高达 39 %。因此,当伊布替尼联合其他免疫药物时可以考虑曲霉菌的预防。艾沙康唑对比其他三唑类抗真菌药物有较少的药物相互作用,与伊布替尼联合给药可以预防真菌感染。伊布替尼治疗相关的侵袭性真菌病的重要临床特征包括:缺乏传统感染的典型的风险因素(如中性粒细胞减少、淋巴细胞减少);伊布替尼初始治疗后的 2-4 个月,之后较少出现;中枢神经系统曲霉病高发,高达 45 %。在伊布替尼治疗后患者中出现侵袭性霉菌病,揭示了 BTK 在吞噬细胞激活和抗真菌方面的重要作用。最后,在接受伊布替尼治疗的患者中,有 1 % 报告了严重的病毒感染,主要是呼吸道病毒性肺炎。第二代 BRK 抑制剂如 acalabrutinib 仅抑制 BTK,对比第一代 BTK/ITK 抑制剂如伊布替尼,感染的易感性是否一致,仍待观察。
达沙替尼,第二代多靶向酪氨酸激酶抑制剂也与严重感染风险的增高有关,包括造血系统移植患者中出现严重的细菌感染(主要是败血症、肺炎和软组织感染)、巨细胞病毒感染、PJP 和乙肝的激活。巨细胞病毒感染和 PJP 也发生在使用磷脂酰肌醇-3-激酶(PI3K)抑制剂 idelalisib 的患者身上。在达沙替尼治疗的患者中,进行 PJP 预防是有必要的。脾脏酪氨酸激酶(SYK)抑制剂 fostamatinib 的早期经验尚未确定主要的感染易感性。然而,SYK 位于真菌感知 c 型凝集素受体/CARD9 信号通路的中心位置,而遗传性 CARD9 缺陷患者对中枢神经系统的黏膜和侵袭性真菌感染表现出高度敏感性,这是由感染过程中受损的小胶质中性粒细胞反应导致的中枢神经系统中性粒细胞减少引起的。因此,临床认识到 fostamatinib 治疗的患者可能发生真菌感染,粘膜念珠菌病和皮肤真菌感染的报道在这类患者中不断出现。
CAR-T 细胞治疗相关的感染并发症
CAR-T 细胞是对其他治疗无效的 B 细胞恶性肿瘤患者的一种有效的治疗选择。CAR-T 细胞通过基因工程表达一种受体,该受体识别癌细胞上的靶蛋白,当存在靶蛋白时,无论是肿瘤细胞还是正常细胞,都可以诱导杀伤靶蛋白表达的细胞。目前 FDA 批准的 CAR-T 细胞靶向 B 细胞恶性肿瘤的 CD 19,但是针对 B 细胞恶性肿瘤和其他癌症的其他抗原的 CAR-T 细胞目前正在开发中。
尽管 CAR-T 细胞疗法在一些患者身上被证明是成功的,但它并不是对所有患者都有效,而且并非没有风险。CAR-T 细胞治疗相关的毒性包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)和 B 细胞再生发育不良,但其他毒性正在出现,包括血细胞减少的延长,这可能与原疾病、之前的治疗,甚至 CAR-T 细胞相关毒性有关。CRS 和 ICANS 通常是急性的,应在 CAR-T 细胞治疗后密切监测;他们都具有强大的免疫激活能力,可能导致促炎因子风暴,对多个器官产生负面影响。这些细胞因子水平的增高,或相关的治疗可能导致感染或血细胞减少的延长。
接受 CAR-T 细胞治疗的患者的感染可能是潜在的恶性肿瘤和之前肿瘤治疗的直接结果。大多数患者之前都接受过多种可能增加感染风险的治疗,比如使用过淋巴细胞清除的药物氟达拉滨,它会导致长期的淋巴细胞功能障碍,或者使用像阿仑单抗(alemtuzumab)这样的消耗 T 细胞的抗体,这种抗体有时在异基因造血细胞移植的时候使用。CAR-T 细胞治疗的预处理方案通常包括中度剂量的化疗(环磷酰胺和氟达拉滨),这会导致淋巴细胞减少;正常的细胞免疫可能数年都无法恢复,而骨髓细胞通常在一周内恢复。然而,一些患者在治疗 28 天后存在血细胞减少。生长因子支持通常要等到 CRS 和 ICANS 的最大风险时间窗已经过去,或者患者从 CRS 和 ICANS 中恢复后才开始。因此,在治疗开始最初的 28 天,感染最易发生。大多数感染的发生可能在治疗的最初 6 天,并且如果患者有血细胞减少的延长,感染可能甚至持续到 21 个月。对于造血细胞移植的患者,早期感染(定义为移植后 28 天内)更可能为细菌感染,而晚期感染更容易由病毒引起。CAR-T 细胞治疗患者的真菌感染风险尚未得到明确评估;正在制定的指南建议在 CAR-T 细胞治疗后的第一个月进行抗真菌治疗,如果细胞减少持续存在,可以按照护理标准继续进行。
免疫抑制相关感染也可能是 CRS 和 ICANS 管理策略造成的。使用高剂量皮质类固醇和/或托珠单抗治疗 CRS 和 ICANS,以抑制炎症放大。皮质类固醇的风险是众所周知的,并建议尽快降低剂量。虽然托珠单抗可能掩盖发烧,但在 CAR-T 细胞治疗的患者中与托珠单抗相关的严重感染的发生还没有得到充分的研究。在风湿病文献中,长期使用托珠单抗与感染风险增高相关。尽管大多数接受 CAR-T 细胞治疗的患者在 CAR-T 细胞治疗后的 1-2 周内只接受了 1-2 次托珠单抗,但总的来说,治疗 CRS 与增加感染风险有关。重症监护病房在管理 CRS 时,中心静脉导管和无菌导尿管,可进一步增加感染风险。
CD19 CAR-T 细胞除了靶向癌细胞外,还会耗尽正常 B 细胞,导致持续不同时间和不同程度的 B 细胞再生障碍和低丙种球蛋白血症。这也可能发生在 CAR-T 细胞治疗之前发生,作为先前治疗的结果,并可能在 CAR-T 细胞治疗后加重。由于 CAR-T 细胞的扩增和持久性,低丙种球蛋白血症可持续数年。在一项研究中,67 % 的患者在治疗 90 天后出现低丙种球蛋白血症,尽管 43 % 的患者在 CAR-T 细胞输注前出现过低丙种球蛋白血症。这些患者在治疗后期特别容易感染,特别是肺部感染。在同一项研究中,61 % 的患者在首次 CAR-T 细胞治疗 90 天后至少有一次感染。虽然临床上还没有乙肝病毒再激活的报道,但这可能是由于在 CAR-T 细胞治疗之前常规检测乙肝,并且同利妥昔单抗一样,给予抗病毒预防。
综上所述,尽管 CAR-T 细胞治疗存在感染的风险,但大部分的风险是由恶性血液病的历史和以前的治疗引起的,而且大多数感染都是根据标准护理进行管理的。CAR-T 细胞输注后的第一个月、之前的恶性肿瘤、预处理化疗方案、CRS 和 ICANS 均可能增加严重感染的风险。面对感染应早期积极治疗,即使尚未确认诊断。虽然 B 细胞复苏的测量和/或 γ 球蛋白可以帮助管理与免疫球蛋白替代疗法的长期感染风险,但 CAR-T 细胞疗法的长期随访表明是安全。替代丙种球蛋白在儿童急性淋巴细胞白血病和 CAR-T 细胞治疗中是常规的,但仅仅在成人淋巴瘤和持续低丙种球蛋白血症中复发的肺部感染患者应用。美国移植和细胞治疗学会正在制订包括毒性分级、感染预防在内的管理指南。
结论
对肿瘤和自身免疫性疾病使用新的生物和细胞疗法会导致复杂的医源性免疫缺陷状态,并增加感染风险。提高临床试验中感染的认识、增强临床试验中感染的报告和监测,以及研究了解与新型生物和细胞疗法相关的感染的流行病学和发病机制,有助于临床医生更好的诊断、疫苗接种、药物预防和治疗此类感染。
