在免疫性肾脏病和肾移植等肾脏病领域中,治疗挑战主要是建立或者重建免疫耐受。如果能达到免疫耐受,将达到治疗目标或者不再需要使用免疫抑制剂。免疫耐受治疗可能更具特异性,短期与长期的副作用更少。过去,肾脏病领域从肿瘤学中借鉴各种免疫疗法,从 1960 年代的环磷酰胺到 2000 年的利妥昔单抗,均获成功。
最近,美国食品与药品管理局通过了用于治疗血液肿瘤的新疗法。该疗法通过嵌合抗原受体 T 细胞(CAR-T)达到治疗目的,其成功的临床试验结果可能为肾脏病中的免疫治疗提供新的疗法。来自澳洲 Monash 大学 A. Richard Kitching 和 Juli Jaw 对此进行了评论,发表在最近一期的 Kidney international 杂志上。
这种疗法通过基因工程修饰自体同源 T 细胞,这种 T 细胞不需要通过主要组织相容性复合物(MHC, 在人类为白细胞分化抗原 HLA)即能识别特定靶抗原。免疫球蛋白直接与抗原或者抗原性肽结合,需要借助 CD8+和 CD4+T 细胞的受体 (TCR) 识别并结合靶细胞表面的肽/MHC 复合物(图 1a)。CAR-T 细胞能跳过 MHC 的抗原识别。通过白细胞流式细胞仪获取患者的 T 细胞,然后在体外通过病毒载体在 T 细胞中引入 CAR 蛋白。
CARs 包含细胞外、跨膜和细胞内组分。细胞外组分是一种单链的抗体片段,能结合细胞表面特异性抗原(如肿瘤相关性抗原),不需要细胞内过程和由 MHC 提呈抗原。跨膜组分连接细胞外组分与细胞内组分,其包括 T 细胞活化组分和共刺激组分。虽然第一代 CAR 只携带 T 细胞活化组分,新增加的共刺激组分协助 T 细胞活化、增加体内效价和 CAR-T 细胞的体内存活。在转染后,CAR-T 细胞被筛选并在体外增值,需时约 17~39 天。经 CAR 修饰后的 T 细胞克隆,回输到经过化疗药物处理后的患者体内。
经过化疗处理将有利于 CAR-T 细胞在体内增殖。人类中 CAR-T 细胞常是 CD8+细胞毒 T 细胞,能结合并杀死肿瘤细胞(图 1b)。对于通过 B 细胞连接标志物 CD19 标靶的淋巴瘤靶细胞,反应率和持续缓解率均非常高。
CAR-T 细胞常见的副作用包括脑病等神经毒性、可能引起急性肾损伤的细胞因子释放综合征。对于细胞因子释放综合征,可通过抗白介素-6 抗体,如 tociluzimab 等减轻。其他在 CAR-T 疗法治疗肿瘤时可能出现的副作用包括溶瘤综合征、低钾血症和低磷血症等电解质异常。
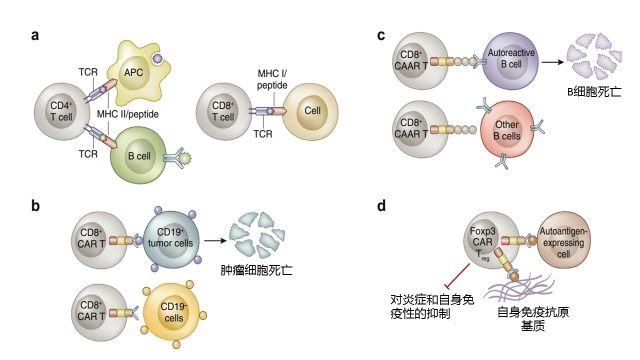
图 1 嵌合抗原受体 T 细胞免疫疗法 (CAR-T) 及其在免疫疾病中的使用
(a) 传统的抗原识别是通过 CD4+和 CD8+细胞的肽/主要组织相容性复合物(MHC)进行;(b) CD8+的 CAR-T 细胞在 B 细胞性淋巴瘤中,不需要肽/MHC 的特殊抗原识别就能杀死 CD19+细胞;(c) 通过嵌合具有 B 细胞特异性受体的自身抗原受体(CAAR)T 细胞,特异性地抗原识别杀死自身反应性 B 细胞;(d) CAR 调节 T 细胞 (Treg) 通过结合细胞表面或基质蛋白结合,成为抗原特异性的调节细胞,这样无需通过肽/MHC 复合物进行结合,可能将减少局部和系统的炎症和自身免疫性反应。
APC:抗原提呈细胞细胞; Foxp3: 叉头盒子 P3; TCR: T 细胞受体。
CAR-T 细胞疗法在免疫性肾病和肾移植的治疗中,至少有以下两种形式。CD8+CAR-T 可能以病理性的自身反应性 B 细胞作为靶点。例如,生成镶嵌自身抗原受体(CAAR)的 T 细胞,这种 T 细胞能表达相关的自身抗原,通过与反应性 B 细胞相互作用,吸引并结合自身反应性 B 细胞 (图 1c)。这种治疗已经在试验性的天疱疮中获得成功,可能是现有的如利妥昔单抗的非选择性 B 细胞去除疗法的另一种新的进步。
另外,CAR-T 细胞可作为调节性 T 细胞 (Tregs),协助建立移植耐受和在 ANCA 相关性血管炎、抗磷脂 A2 抗体膜性肾病、Good-Pasture 病、狼疮性肾炎、IgA 肾病等免疫性肾病中重建免疫耐受。多克隆 Tregs 已经在肾移植和免疫性疾病中,作为细胞疗法进行研究。Tregs 细胞能通过多种形式进行制作并扩增。其中一种方法是使用特异性的单链变量片段作为 CAR 的细胞外组分(图 1d)。这种疗法已经在多种疾病,如人型化的移植抗宿主疾病、皮肤移植、自身免疫性脑病等获得成功。
CAR-T 细胞在肿瘤治疗中获得成功,可能为自身免疫性肾病的治疗提供新的疗法。新一代的 CAR-T 细胞疗法可能克服上一代的不足,更为先进。这种细胞疗法对于免疫性肾脏病具有潜在的治疗价值,甚至可能治愈疾病,有待进一步研究。
